DMSO在室温下是一种无色透明的液体,纯度较高时分子间会形成具有链式聚合物结构的缔合物,导致其熔点(18.45℃)及沸点(189℃)均较高。以下表格还列出了DMSO其他重要的物理常数及热力学数据。与DMF类似,这种化合物也可用作极性非质子型溶剂,与水及大多数常见的有机溶剂混溶,但极性比前者更大。DMSO能很好地溶解许多有机、无机化合物,加之毒性较低,在学术及工业界应用均十分广泛。目前,人们主要从二甲基硫醚(Me2S)出发,使用O2或NO2作为氧化剂工业化生产DMSO。
DMSO重要的物理常数及热力学数据

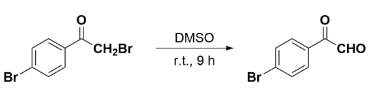
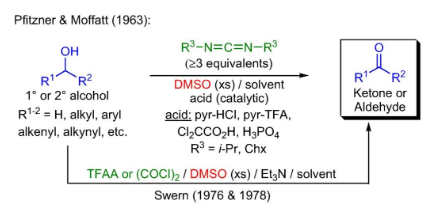
DMSO同样可作为反应物参与多种有机化学反应。早在1957年,美国普渡大学(PurdueUniversity)的WilliamM.Weaver教授等人将不同结构的α-溴代酮溶于DMSO中,部分底物中的C-Br键在室温下可高效转化为羰基,首次发现DMSO具有一定的氧化活性。长期以来,DMSO一直扮演着溶剂的角色。自此,人们开始深入发掘这种化合物在有机合成领域的其他应用,大家熟知的Pfitzner-Moffatt氧化、Swern氧化等有机人名反应都是利用DMSO作为氧化剂将醇氧化为相应的醛/酮。
α-溴代酮在DMSO的作用下氧化为α-羰基醛
Pfitzner-Moffatt氧化与Swern氧化
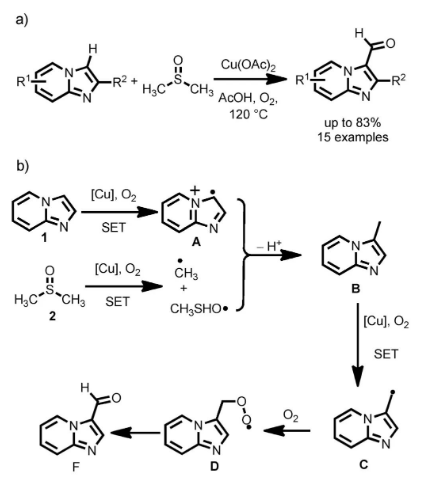
从结构上看,DMSO中包含两个甲基,理论上可作为C1合成子在母体分子中引入甲基(CH3)、亚甲基(-CH2-)乃至甲酰基(CHO)、氰基(CN)等各种片段。例如,2015年,广东药科大学的曹华教授报道了一种Cu催化咪唑并吡啶选择性3位C-H键甲酰化的方法。其中DMSO可通过单电子转移(SET)途径产生甲基自由基,与咪唑并吡啶偶联后得到甲基化中间体B,B在O2的作用下进一步发生氧化得到目标产物。另外,DMSO中的甲基亚磺酰(SOMe)部分还可作为甲硫基(-SMe)、甲磺酰基(-SO2Me)来源用于不同类型的化学转化。
DMSO作为合成砌块在有机合成中的应用
Cu催化咪唑并吡啶选择性3位C-H键甲酰化
此前我们提到,纯净的DMF具有良好的热稳定性。杨强博士利用差示扫描量热仪(DSC)对DMF在高温下放热分解的情况进行分析,发现其在N2氛围下升温至400℃也未出现明显的分解,而与酸、碱、含卤化合物等其他类型的反应组分混合,加热至特定温度才可能发生反应失控的情况。DMSO则不然,相比之下,借助DSC测定纯净DMSO的热稳定性,约278℃时便会发生明显的放热分解。换用加速量热仪(ARC),这种化合物在达到沸点(189℃)时同样如此。
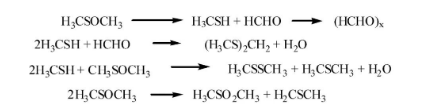
2016年,圣莱科特(SIGroup)公司的B.ToddBrandes博士结合早年其他人的研究,并利用多种量热系统及气相色谱-高分辨质谱联用仪(GC-HRMS)对DMSO热分解的热力学数据和产物进行全面的优化和分析,最终汇总出这种化合物分解可能得到的所有产物。如下表所示,其组成十分复杂。一般认为,DMSO在加热时首先会分解为HCHO和MeSH,经后续转化再得到Me2S、MeSSMe、H2O等混合产物。除此之外,DMSO也可通过自歧化反应形成Me2S、Me2SO2。
DMSO热分解可能形成的产物汇总

DMSO热分解可能的反应途径
当然,假使DMSO用作溶剂与特定的反应组分混合,放热分解的起始温度(onsettemperature)将更低,由此出现安全问题的几率也会随之增加。尽管从上世纪50年代起,因DMSO引发的反应事故并不少见,但似乎并未引起足够的重视。部分期刊、书籍仍将DMSO列为安全系数很高的溶剂。早年一些企业为了节约成本,通过精馏的方式对反应后处理体系中的DMSO进行回收利用,操作不当导致人身伤亡。为此,杨强博士又在化学期刊Org.ProcessRes.Dev.上发表了一篇题为PotentialExplosionHazardsAssociatedwiththeAutocatalyticThermalDecompositionofDimethylSulfoxideandItsMixtures的文章,按照与DMSO混合的反应物类型进行划分,逐一讲解相应体系升温后可能存在的隐患,为大家敲响警钟。

酸
早在20世纪初,人们便意识到Brønsted酸会极大地促进DMSO的热分解。1959年,美国杜邦公司(E.I.duPontdeNemoursandCompany)的HaroldR.Nace博士发现一级、二级(拟)卤代烷烃(X=Cl,Br,OSO2Ph)在DMSO中加热至100~160℃可转化为对应的醛、酮,与此同时产生Me2S、MeSH、MeSSMe等低沸点副产物。反应过程中还会生成Brønsted酸HX,倘使不加入Na2CO3作为缚酸剂,体系中则出现大量的HCHO,侧面说明HX对DMSO的热分解具有重要的影响。
(拟)卤代烷烃在DMSO中加热转化为对应的醛、酮
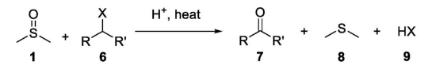
上文提及的B.ToddBrandes博士分别在DMSO中加入1%(质量分数)的H2SO4、MsOH,通过DSC分析其放热分解的情况。相比DMSO纯品,两者热分解的起始温度均发生明显的下降(分别为192、226℃),释放的热量也一定程度增加。其他人也报道了各种不同的Brønsted酸与这种溶剂混合对上述热力学数据的影响,杨强博士将其汇总整理并绘制成表格,结果如下表所示。对于大家经常使用的浓HCl(37wt%),混合体系在达到110℃时便出现显著的放热分解。
各种不同的Brønsted酸与DMSO混合对其放热分解的影响
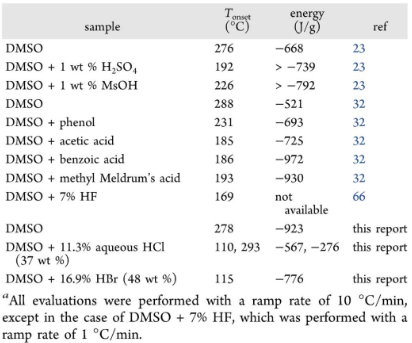
这种问题不限于在反应中加入Brønsted酸作为添加剂,更容易被人们忽视的是反应物及其中间体分子中本身就包含具有Brønsted酸性的COOH。例如,2006年,爱克发·吉华(Agfa-GeVaertN.V)公司的MarcusBollyn博士系统评估了以对羧基苯肼(15)作为原料构建摄影感光材料活性成分21时整个合成过程的安全性,其间涉及四步化学转化,中间体产物17-20均保留了COOH,且一直使用DMSO作为溶剂。
摄影感光材料活性成分21的合成
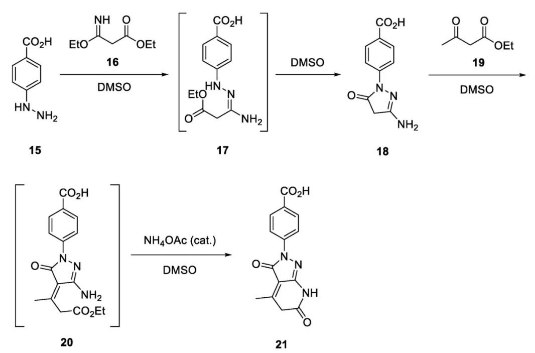
他利用ARC分析了每一步反应放热分解的情况,发现所有反应体系中DMSO的热分解起始温度均大幅度下降,最低可达112℃,尤其是最后一步,扩大合成规模将带来很大的隐患。相比之下,将苯甲酸中间体17转化为相应的钠盐再设计环化过程,体系的热稳定性明显提高。最终他们对合成工艺进行适当改进,换用分批合成的方式确保安全,同时以敞开体系开设反应并延长投料时间。最后一步反应还加入2-甲氧基丙醇作为混合溶剂。
讲到这里,不得不重提一下Pfitzner-Moffatt氧化反应。其间DMSO同时用作溶剂和氧化剂,还要加入催化剂负载量的Brønsted酸(如无水H3PO4、Cl2CHCOOH)推动反应顺利进行。可想而知,扩大反应量级时安全问题也随之而来。对于α-羟基酰胺24氧化为1,2-二酮25的过程,艾伯维(AbbVie)公司的ZheWang博士提出改用DMAc作为溶剂,并将DMSO的用量控制在8当量,既能高效完成目标转化,又可保证大规模合成时的安全。
Pfitzner-Moffatt氧化扩大反应规模时条件的优化
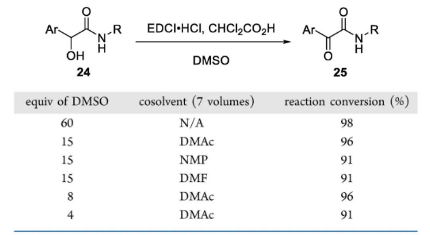
介绍这两项工作也是为了提醒大家,尽管DMSO与酸混合存在一定的隐患,但假使设计反应时无法规避,也可采取有效的措施尽可能降低其风险。



