抽象
尽管二甲基亚砜(DMSO)的医学应用临床试验在1960年代报告了毒性,但后来,FDA将DMSO归类为最安全的溶剂类别。DMSO在许多生物医学领域得到广泛应用,生物效应被忽视。与此同时,生物医学科学已经朝着敏感的高通量技术和新的研究领域发展,包括表观基因组学和microRNA。考虑到其广泛的用途,特别是用于冷冻保存和体外测定,我们使用这些技术创新评估了DMSO的生物学效应。我们将3D心脏和肝脏微组织暴露于含有或不含有0.1%DMSO的培养基中,并分析了转录组,蛋白质组和DNA甲基化谱。在这两种组织类型中,转录组分析检测到>2000个影响相似生物过程的差异表达基因,从而表明DMSO的跨器官作用一致。此外,microRNA分析揭示了心脏microRNA的大规模失调和肝脏微组织中较小但仍然巨大的影响。全基因组甲基化模式也揭示了组织特异性。虽然肝脏微组织显示出不显着的变化,但心脏微组织的发现表明DNA甲基化机制的破坏导致全基因组的变化。microRNA的极端变化和表观遗传景观的改变表明DMSO不是惰性的。应重新考虑其使用,特别是用于胚胎和卵母细胞的冷冻保存,因为它可能会影响胚胎发育。
介绍
二甲基亚砜(DMSO)是一种具有两亲性性质的有机极性非质子分子,是溶解难溶性极性和非极性分子的理想选择。DMSO被广泛用作毒理学和药理学中的溶剂,用于细胞的冷冻保存,以及在拓扑处理过程中用作渗透增强剂。DMSO的使用非常明显,以至于通常没有报告应用的浓度。DMSO通常被认为是低于10%(v / v)的无毒,在实践中,假设DMSO的影响可以忽略不计1–3.
从1960年代到1990年代的研究指出了DMSO的许多生物学相关影响。它甚至被积极研究用于医疗用途,但由于副作用特别影响眼睛,大多数临床试验在1965年被美国食品和药物管理局(FDA)停止。此时,DMSO被认为毒性极强,可与沙利度胺相媲美4,5.DMSO的效果因剂量和给药途径而异。将DMSO浓度高于50%引入血液中会导致即时溶血,白细胞堆积和纤维蛋白原沉淀,而静脉直接注射DMSO可引起局部刺激和坏死6.从猴子获得的LD50值表明,在皮肤上涂抹880克或静脉注射320克将导致50公斤人类的死亡率为80%7.这种相对较高的剂量改变了对DMSO毒性的看法,FDA将DMSO归类为与乙醇相同的类别,即3类溶剂,这是最安全的类别,在药物中通常接受的水平下具有低毒性潜力8.这使得DMSO的广泛使用成为可能。
虽然通常在相对较低的浓度下使用,但DMSO仍然具有医学上有用的特性,例如诱导抗炎,神经阻塞(镇痛),利尿剂,血管舒张和肌肉松弛9.此外,在细胞生物学中,DMSO还用作细胞分化的诱导剂,自由基清除剂和放射保护剂,但最常用于冷冻保存。用于研究的细胞培养物通常使用缓慢冷却方法储存在液氮中。为了防止细胞内冰晶的损害,在储存在液氮中之前,在80%DMSO存在下将细胞缓慢冷却至-10度3.然而,该程序对于生物医学应用是不够的。由于缓慢冷却仍然会因细胞外冰晶而引起损害,因此用于体外受精(IVF)的人卵母细胞和胚胎的冷冻保存是通过玻璃化完成的,其中使用更高浓度的冷冻保护剂来防止冰的形成不仅在细胞中,而且在整个溶液中。通过使用混合物(例如15%DMSO与15%乙二醇组合)获得更高的浓度,从而减少单个冷冻保护剂的量和毒性10.此外,DMSO很容易穿过低等动物和人类的大多数组织膜9.例如,在拓扑应用后2小时,DMSO穿透了大鼠中所有研究的硬组织和软组织(6和15个)。11.DMSO还能够增强其他低分子量化合物的渗透性,从而使它们像通常一样通过膜或深入组织12,这种性质在拓扑疗法中非常有用。2009年,第一个获得FDA批准拓扑DMSO用途的是PENNSAID,它在载体中含有双氯芬酸,DMSO含量为45.5%。®13,14.在拓扑应用中,这种相对高浓度的DMSO是必要的,因为皮肤比细胞膜更难穿透。
对DMSO分子效应的大多数见解都是在上个世纪通常使用高剂量获得的。与此同时,生物医学科学已经朝着更敏感的高通量技术和新的研究领域发展,包括表观基因组修饰和microRNA介导的基因沉默。考虑到它在许多生物学领域的广泛使用,我们分析了相对低剂量的DMSO(0.1%,通常用于细胞测定),以研究对蛋白质组,转录组和表观基因组的影响。为此,我们将体外3D微组织(成熟的iPSC衍生的心脏模型和成熟的肝脏模型)暴露于0.1%DMSO中,并在7周内(2小时,2小时,8小时,24小时,72小时,168小时和240小时)在336个不同时间点收集样品一式三份。此后,通过全转录组分析(使用核糖耗尽的总RNA测序和microRNA测序),全基因组甲基化分析(使用MeDIP-seq)和蛋白质组学分析(使用质谱)评估DMSO效应。我们的分析清楚地表明,DMSO不能被认为是生物学惰性的,但会诱导microRNA(miRNA)和表观遗传景观的大幅改变,特别是在成熟的心脏模型中。
结果
将成熟心脏模型和成熟肝脏模型的人类3D微组织(MTs)暴露于含有或不含有0.1%DMSO的培养基中两周,采样时间为2、8、72、168、240和336小时。在从同一样品获得的材料上测量蛋白质组(大约 2,000 个测量的蛋白质)、全转录组(包括 miRNA)和全基因组甲基化。数字1包含实验设计的图形概述。为了初步了解DMSO诱导的跨组学效应,总结了每个平台的差异变化实体的数量(均使用FDR<0.05)进行多次测试校正)。不同组织类型之间差异变化的实体数量不同,心脏样本显示DMSO比肝脏更大的影响,但mRNA除外。这种差异对于miRNA和基因组甲基化尤其明显。由于蛋白质组学数据由于其部分性质而信息最少,因此这些结果包含在补充数据中。此外,主成分分析(PCA),使用每个平台一式三份的平均值(图)。2&补充数据)描述了0.1%DMSO暴露(DMSO)和未处理(UNTR)样品之间的明显差异,但肝脏MT中的甲基化除外。
包含图片、插图等的外部文件。
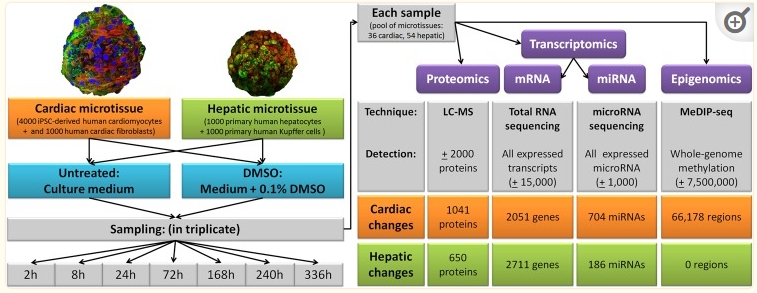
图1
实验设计的图形概述与每种分析方法的差异实体摘要相结合。组织特异性信息以橙色表示心脏,绿色表示肝脏。此外,曝光为蓝色,测量平台为紫色。缩写:h = 小时;mRNA = 信使 RNA;miRNA = microRNA。
包含图片、插图等的外部文件。

图2
PCA描述了DMSO和UNTR在所有测量平台上的差异。(a) RNA的PCA表明DMSO(三角形)和UNTR(圆圈)之间的RNA表达存在明显差异。心脏样本(左)与肝脏样本(右)相比,与 UNTR 更不同。(b)miRNA的PCA揭示了心脏样本中DMSO和UNTR之间的明显分离,而肝脏样本似乎更容易受到暴露持续时间的影响(如与特定时间点相对应的颜色模式所示,见图例)。(c) 促子甲基化的PCA表明DMSO和UNTR在心脏样本中存在差异,但对于肝脏样本则没有差异。
为了研究DMSO的分子效应,使用全转录组分析受影响的细胞过程。此后,通过分析miRNA和基因组甲基化的变化,研究了DMSO对基因表达调控的组织特异性影响。
DMSO对细胞过程的影响
DMSO对mRNA的影响由PCA描述(图)。2a,b).UNTR和0.1%DMSO之间的明确分离表明DMSO能够通过改变基因表达来影响细胞过程。DMSO和UNTR的比较导致2051个差异表达基因(DEGs = FDR <0.05;其中871个在心脏MT中具有|log2FC| >1),在肝脏MT中分别有2711个DEGs(其中1879个具有|log2FC| >1),其中60.7%和62.9%的DEGs分别下调。
DEG的通路分析为了识别受DMSO暴露影响的细胞过程,使用ConsensusPathDB使用DEG进行通路过度表征分析15与精选的 Reactome 数据库16.使用从Reactome途径浏览器获得的(子)途径之间的分层连接对显着过度代表性的途径(q值<0.05)进行排序(补充表1,2).表中包括包含最高层次结构路径级别(从现在开始称为集群)的摘要1用于心脏和工作台2用于肝 MT。
表1
在0.1%DMSO暴露后检测到的心脏DEG和DEP的通路分析。
群集名称(稳定标识符)设置大小排名(DEGs)金额 DEG (%)金额 DEGs (%)|log2FC|> 1Q 值% DEG 下调
细胞对压力的反应 (R-HSA-2262752)393191 (23.5%)28 (7.1%)2.2E-0961.5
疾病 (R-HSA-1643685)5142109 (21.5%)33 (6.4%)4.5E-0961.5
囊泡介导的转运 (R-HSA-5653656)6193122 (20.0%)48 (7.8%)2.7E-0855.7
蛋白质代谢 (R-HSA-392499)15064236 (16.0%)80 (5.3%)9.3E-0768.2
染色质组织 (R-HSA-4839726)274558 (21.3%)19 (6.9%)5.2E-0553.4
肌肉收缩 (R-HSA-397014)198641 (21.0%)11 (5.6%)9.5E-0463.4
基因表达 (R-HSA-74160)17557235 (13.7%)76 (4.3%)6.6E-0355.7
代谢 (R-HSA-1430728)20358269 (13.5%)100 (4.9%)7.9E-0369.1
细胞外基质组织 (R-HSA-1474244)295951 (17.6%)23 (7.8%)8.1E-0352.9
免疫系统 (R-HSA-168256)195010257 (13.5%)95 (4.9%)9.7E-0368.1
细胞周期 (R-HSA-1640170)5511185 (15.7%)34 (6.2%)1.0E-0254.1
脱氧核糖核酸修复 (R-HSA-73894)3231254 (17.1%)17 (5.3%)1.1E-0261.1
细胞器生物发生和维护 (R-HSA-1852241)3101350 (16.5%)20 (6.5%)2.7E-0266
发育生物学 (R-HSA-1266738)74814104 (14.1%)33 (4.4%)5.6E-0257.7
止血 (R-HSA-109582)6931597 (14.2%)36 (5.2%)5.6E-0268
细胞间通信 (R-HSA-1500931)1311622 (17.1%)7 (5.3%)1.1E-0168.2
小分子运输 (R-HSA-382551)6281775 (12.1%)28 (4.5%)4.4E-0165.3
神经元系统 (R-HSA-112316)3511834 (9.8%)13 (3.7%)9.2E-0147.1
信号转导 (R-HSA-162582)253819260 (10.4%)93 (3.7%)9.9E-0158
粗体文本:非常显著(聚类 q < 0.01);斜体文本:显著(聚类 q < 0.05);文本:聚类不显著,但包含显著 (q < 0.05) 子通路。集群名称旁边显示的稳定标识符可用于从 Reactome 数据库中检索完整的通路信息。
表2
在0.1%DMSO暴露后检测到的肝脏DEG和DEP的途径分析。
群集名称(稳定标识符)设置大小排名(DEGs)金额 DEG (%)金额 DEGs (%)|log2FC|> 1Q 值% DEG 下调
代谢 (R-HSA-1430728)20351472 (23.7%)272 (13.4%)9.1E-2358.9
囊泡介导的转运(R-HSA-5653656)6192164 (26.8%)96 (15.5%)4.8E-1151.5
细胞外基质组织 (R-HSA-1474244)295381 (28.0%)55 (18.6%)2.5E-0677.8
疾病 (R-HSA-1643685)5144124 (24.5%)77 (15.0%)3.6E-0661.3
免疫系统 (R-HSA-168256)19505371 (19.5%)220 (11.3%)1.0E-0558.5
肌肉收缩 (R-HSA-397014)198658 (29.7%)40 (20.2%)1.4E-0582.8
蛋白质代谢 (R-HSA-392499)15067291 (19.7%)176 (11.7%)9.3E-0559.9
细胞对压力的反应 (R-HSA-2262752)393888 (22.7%)59 (15.0%)2.1E-0369.3
止血(R-HSA-109582)6939141 (20.6%)88 (12.7%)3.2E-0356.7
发育生物学 (R-HSA-1266738)74810149 (20.2%)85 (11.4%)4.9E-0369.1
细胞间通信 (R-HSA-1500931)1311135 (27.1%)21 (16.0%)6.8E-0362.9
程序性细胞死亡 (R-HSA-5357801)1251233 (26.8%)15 (12.0%)1.0E-0254.5
小分子运输 (R-HSA-382551)62813114 (18.4%)75 (11.9%)1.2E-0158.8
信号转导 (R-HSA-162582)253814377 (15.1%)257 (10.1%)8.5E-0164.5
神经元系统 (R-HSA-112316)3511544 (12.6%)31 (8.8%)9.8E-0168.2
基因表达 (R-HSA-74160)175516239 (14.0%)145 (8.3%)1.0E + 055.6
粗体文本:非常显著(聚类 q < 0.01);斜体文本:显著(聚类 q < 0.05);文本:聚类不显著,但包含显著 (q < 0.05) 子通路。集群名称旁边显示的稳定标识符可用于从 Reactome 数据库中检索完整的通路信息。
通过对DEG的通路分析,在心脏MT中发现了225个显著过度代表性的通路(q值<0.05),对应于19个簇(在通路浏览器中总共25个簇中),167个通路对应于肝MT中的16个簇。组织类型之间存在大量重叠,在两者中均发现了60条通路和15个簇。尽管不同组织类型之间的DMSO效应程度存在差异,但DMSO受影响的生物过程似乎不是组织特异性的。
受DMSO影响最大的簇是肝MT中的“代谢”簇。在这里,大多数影响是在“柠檬酸循环和呼吸电子传递”途径中发现的(q值:3.5 * 10−10,63个基因中的171个DEGs,76.2%下调),“葡萄糖代谢”(q值:9.9 * 10−9,36个基因中的77个DEGs,80.5%下调)和“脂质和脂蛋白的代谢”(q值:2.9 * 10−6,165个基因中的728个DEGs,55.2%下调)。使用DEGs在心脏MTs中未检测到脂质和脂蛋白代谢的变化,但观察到DMSO对“柠檬酸循环和呼吸电子传递”的类似影响(q值:1.3 * 10−12,58个基因中的171个DEGs,65.5%下调)和“葡萄糖代谢”(q值:2.8 * 10−3,20个基因中的77个DEGs,55.0%下调),尽管与肝脏MTs相比,心脏MTs中下调的基因较少。
DMSO治疗在两种组织类型中受到高度影响的另一个集群是“囊泡介导的运输”。该簇中的DMSO效应主要在与高尔基体介导的蛋白质转运和分泌相关的过程中检测到。在这一过程中,“ER到高尔基体顺行性运输”受影响最大(心脏:q值:2.4 * 10−6,38个基因中的134个DEGs,68.4%下调;肝脏:q值:1.0 * 10−5,44个基因中的134个DEGs,44.4%下调)。该途径也是“蛋白质代谢”簇的一部分,该簇还揭示了DMSO对“天冬酰胺N-连接糖基化”的影响(心脏:q值:2.1 * 10−6,64个基因中的283个DEGs,76.6%下调;肝脏:q值:1.2 * 10−7,83 个基因中的 283 个 DEG,54.8% 下调),这是将蛋白质从 ER 运输到高尔基体所必需的转录后蛋白质修饰17.
尽管在两种组织类型中都检测到“细胞对压力的反应”簇,但过度代表的途径不同。心脏MTs的“细胞衰老”受到显着影响(q值:2.6 * 10−4,通路大小:192,42 DEG,64.3% 下调),但在肝 MT 的通路分析中未检测到。最后,受DMSO影响的其他心脏特异性簇是“细胞周期”,“DNA修复”,“细胞器生物发生和维持”,以及“染色质组织”的显着簇(q<0.01)。由于在两种组织类型中都发现了受影响最大的途径,这表明DMSO的稳健作用。
在基因表达和翻译调控中观察到的DMSO效应
在心脏MT的通路分析中已经检测到与基因表达和翻译调节相关的通路(表3).虽然这些途径在肝脏MT中没有过多代表,但检测到的DEG量表明DMSO能够影响这些过程,并可能诱导细胞模型的生物学改变。
表3
与转录调控相关的途径。
设置大小心脏肝
度Q 值下调的 % DEG度Q 值下调的 % DEG
RNA的基因沉默13435 (26.7%)3.8E-0574.325 (19.1%)3.6E-0172.0
小RNA的转录调控10832 (30.2%)7.6E-0675.024 (22.6%)1.4E-0175.0
微核糖核酸生物发生135 (41.7%)4.0E-0260.01 (8.3%)9.6E-010.0
基因表达的表观遗传调控15431 (20.5%)6.8E-0361.327 (17.9%)4.5E-0177.7
脱氧核糖核酸甲基化6818 (27.3%)3.4E-0366.613 (19.7%)4.4E-0192.3
在微RNA调控中观察到的DMSO效应在miRNA的测序数据中观察到DMSO的组织特异性影响。在1,105个测序的心脏miRNA中,704个(= 63.7%)差异表达(DE,FDR <0.05),59.5%显示下调。此外,PCA图(图。2c)揭示了治疗组的miRNA之间的明显差异。在肝 MT 中,在 1,033 个测序的 miRNA 中,186 个 (=18%) 是 DE,大约一半的 miRNA 上调 (47.3%)。此外,PCA图不仅揭示了治疗组miRNA之间的明显分离,而且还表明了时间依赖性效应。两个主要成分(时间和剂量)合计占总变异的95%以上,对其他因素的影响很小。
为了研究组织特异性差异的来源,更详细地研究了miRNA生物发生过程中的基因表达变化(图)。3).MiRNA生物发生始于由聚合酶II(11个亚基的复合物)或聚合酶III(10个亚基的复合物)转录的初级miRNA的转录。在心脏MT中,聚合酶II包含1个上调和8个下调基因。在肝MT中,5个基因下调,1个基因上调。虽然肝脏MTs中下调的基因较少,但与心脏MTs相比,倍数变化更大。pri-miRNA切割成pre-miRNA似乎不受DMSO暴露的影响。DICER1(切割前miRNA)在心脏MT中下调,在肝脏MT中上调,描绘了对DMSO暴露反应的明显组织特异性差异。最后,AGO2(编码miRNA-RISC的主要成分)在心脏MT中下调。这一过程中的变化可能导致细胞miRNA含量的差异,从而影响其调节功能。
包含图片、插图等的外部文件。
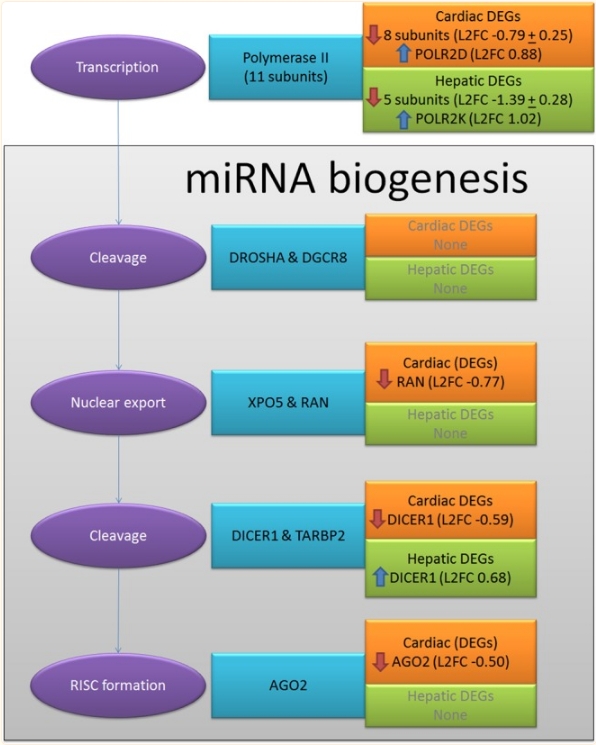
图3
DNA在RNA基因沉默过程中的DMSO效应。miRNA生物发生中的DEGs。整个过程分为子过程(紫色椭圆形)和描绘所涉及的基因(蓝色矩形)和检测到的心脏(橙色矩形)和肝脏(绿色矩形)样品的DEG。
在心脏MT中,miRNA生物发生中的下调基因可以解释极大量的DE miRNA下调,并表明miRNA对基因沉默的极端失调。在肝MT中,唯一显着的变化是DICER1的上调(表3),miRNA生物发生未被DMSO暴露破坏。
为了了解DMSO对miRNA基因沉默的影响,miRTarBase数据库18,包含经过实验验证的microRNA-靶标相互作用(MTI),用于获得检测到的DE miRNA的基因靶标。我们仅纳入了具有有力证据的MTI(通过报告基因测定、蛋白质印迹或qPCR验证)。在704个DE心脏miRNA中,数据库中只有281个(=40%),导致总共2051个基因靶标可能受到DMSO诱导的miRNA基因沉默变化的影响。对于肝MTs,获得了106个DE miRNA的靶标(=57%),共有545个可能受影响的基因。获得的基因靶标用于使用Reactome通路浏览器可视化过度代表的通路(补充图)。3).出乎意料的是,对于两种组织类型,过度代表性的途径位于相同的簇中。观察到“信号转导”,“免疫系统”和“基因表达”的大多数影响。然而,心脏MT的极端失调和关于MTI的有限信息使得对推定的受感染mRNA的任何下游分析都无关紧要。
在表观遗传学中观察到的DMSO效应为了评估DMSO引入的表观遗传改变,我们专注于全基因组DNA甲基化。心脏基因表达的通路分析揭示了DNA甲基化通路的失调。甲基转移酶DNMT1(维持DNA甲基化的关键因子)和DNMT3A(促进DNA甲基化的从头和维持)上调,而在活性去甲基化中起关键作用的TET1在心脏MT中下调(图)。4一).DMSO处理后表观遗传作家的上调和橡皮擦的下调指向基因组高甲基化,这可能会降低转录活性。相反,在肝脏途径分析中,未观察到DNA甲基化的失调。请注意,在两种组织类型中,观察到其他相关表观遗传机制失调的转录证据,例如组蛋白甲基化,其中16个基因和13个基因分别在心脏和肝脏MT中差异表达。
包含图片、插图等的外部文件。
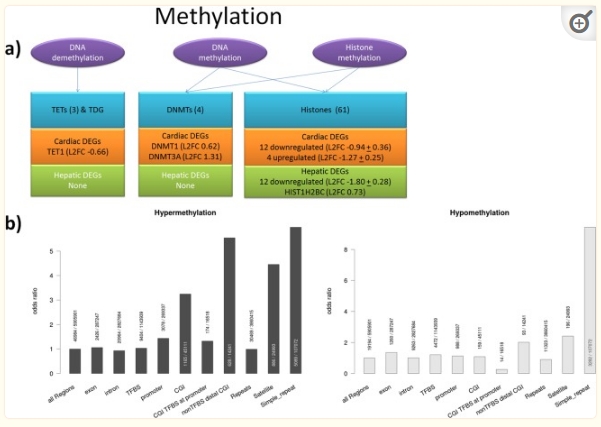
图4
基因表达的表观遗传调控。(a) 参与DNA甲基化的DEG。该过程分为子过程(紫色椭圆形)并描绘涉及的基因(蓝色矩形)和检测到的心脏(橙色矩形)和肝脏(绿色矩形)样品的DEG。(b) DMRs在基因组特征中的相对富集(DMSO与UNTR,FDR 5%)。对于每个特征,描述了重叠 DMR 的数量与相应特征的测试窗口总数。与所有基因组区域相比,高甲基化区域富集用于卫星、简单重复和没有已知监管证据的启动子远端的 CGI,低甲基化区域富集用于简单重复。
MeDIP-seq的全基因组甲基化分析显示,心脏MT中有66,178个差异甲基化区域(DMR;q值<0.05)。这些改变影响了覆盖基因组的1.1%。根据观察到的DNA甲基化写入者和擦除器的转录变化,71%的DMR对应于甲基化的增益(46,984个高甲基化区域与19,194个低甲基化区域)。相比之下,在肝脏MT中,没有DMR通过多次测试的校正。此外,PCA图(图。二 维和)表明治疗组之间在心脏MTs中存在差异,但在肝脏MTs中没有差异。 总之,这说明了DMSO对成熟心脏MTs中甲基组的组织特异性影响,而成熟的肝脏MT似乎不受影响。
为了分析DMR的调控效果,用已知的调控特征注释了这些区域,例如启动子、CpG岛(CGI)、转录因子结合位点(TFBS)和不同类别的重复元件(图)。4b).低甲基化和高甲基化区域都富集了特定的重复类别,例如卫星(高/低甲基化的比值比:4.4/2.4)和简单重复(高/低甲基化比值比6.0/9.4),而重复元素一般没有富集。DMSO对DNMT上调和随后重复序列高甲基化的影响与先前在小鼠拟胚体中的发现一致19.正如预期的那样,在没有监管证据的情况下,高甲基化区域在CGI中也高度富集,例如不与TFBS重叠和转录起始位点远端。这些区域在基因组上的比值比为5.5。虽然CGIs的比值比一般为3.2,但在启动子(具有最佳研究监管潜力的地区)没有CGI与已知TFBS重叠的富集。就像启动子区域一样,外显子、内含子和TFBS等其他特征也受到高甲基化的影响,其几率与捕获的基因组背景大致相同(图)。4b).尽管我们发现了启动子高甲基化与转录抑制同时发生的具体例子,但没有观察到差异启动子甲基化与基因表达之间的全局相关性。在DMSO处理的心脏MT中,148,1个具有高甲基化启动子的基因中只有436个(10.3%)下调。
综上所述,我们的数据暗示DMSO对心脏MT中的DNA甲基化有根本影响,但在肝脏MT中没有。诱导的改变优先影响卫星和简单重复,以及没有已知监管证据的启动子远端的CGI。邻近基因的表达与甲基化差异无显著相关性。因此,我们得出结论,启动子高甲基化的转录抑制不是改变的甲基化标记的主要调节作用,但研究结果表明DNA甲基化机制的全局破坏。



