内容简介
本研究论文聚焦基于喷墨的生物打印过程中生物墨水特性对打印性能和细胞增殖的影响。在生物打印技术中,基于按需(DOD)形成液滴的生物打印方法可以实现微升/纳升的载细胞液滴的非接触式沉积,从而促进细胞-基质和细胞-细胞之间的相互作用。尽管生物墨水在打印过程中起着至关重要的作用,但研究者对于生物墨水对打印性能(液滴拉伸,卫星液滴的形成以及液滴溅射)和细胞健康(存活率和增殖)的影响仍是知之甚少的。本研究中使用惰性聚乙烯吡咯烷酮(PVP360,摩尔质量360kDa)聚合物来调节生物墨水的物理特性,并借此研究生物墨水特性对打印质量和细胞健康的影响。实验结果表明生物墨水的粘弹性有助于稳定丝从喷嘴处的断裂过程。高度拉伸的丝导致了排列整齐的卫星液滴的形成,最大限度地减少了卫星液滴相对预定位置的偏移。其次,生物墨水的粘度在避免了液滴溅射的同时显著提高促进了液滴在湿基底的沉积精度。进一步分析表明高粘度的含细胞生物墨水由于为载细胞液滴撞击基底表面时提供额外缓冲(更高的能量消耗),而展示出较高的细胞存活率和细胞增殖能力。了解生物墨水的特性(如生物墨水的粘弹性和粘度)对打印性能和细胞增殖的影响对新型生物墨水的研发至关重要,我们已经展示了基于活细胞的精准DOD沉积,并利用简便的方式制备了含有多细胞体积可调(nL–µL)的细胞球。
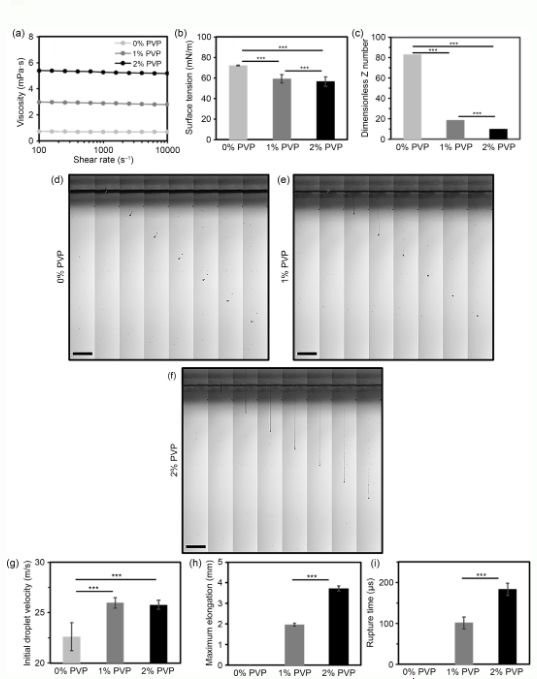
图1(a)-(c)可用于评价生物墨水的可打印性的粘度、表面张力及相应的无量纲参数Z的测量(基于3个样品);(d)-(f)基于(0%,1%,和2%)PVP基生物墨水,以每秒100,000帧拍摄,以每隔4帧叠加的(每秒25,000帧,间隔40µs,比例尺=1mm)液滴形成的代表性图像;(g)喷嘴处的液滴平均初速度;(h)断裂前丝的最长拉伸状态;(i)代表丝从形成至从喷嘴处断裂的持续时间的断裂时间。数据以平均值±标准差的方式呈现,n=15,***p<0.001。PVP:聚乙烯吡络烷酮;1%PVP:0.01g/mLPVP;2%PVP:0.02g/mLPVP
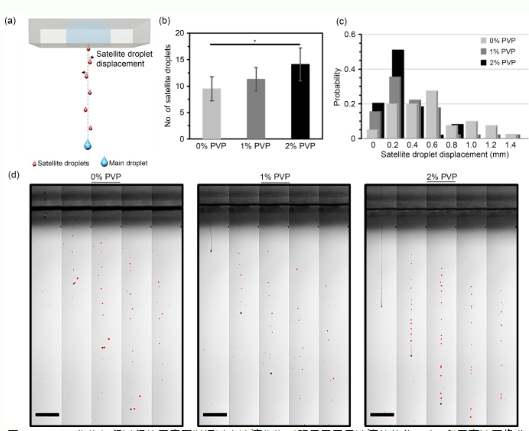
图2(a)DOD生物打印过程的示意图以通过主液滴作为对照显示卫星液滴的位移;(b)利用高速图像分析卫星液滴的数量,n=15,*p<0.05;(c)卫星液滴在打印过程中的位移分析(以90个主液滴作为对照);(d)基于0%,1%,和2%PVP基生物墨水,从喷嘴射出断裂后形成的卫星液滴数量的代表性图像(红色高亮),图像间距是100µs;1%PVP:0.01g/mLPVP;2%PVP:0.02g/mLPVP
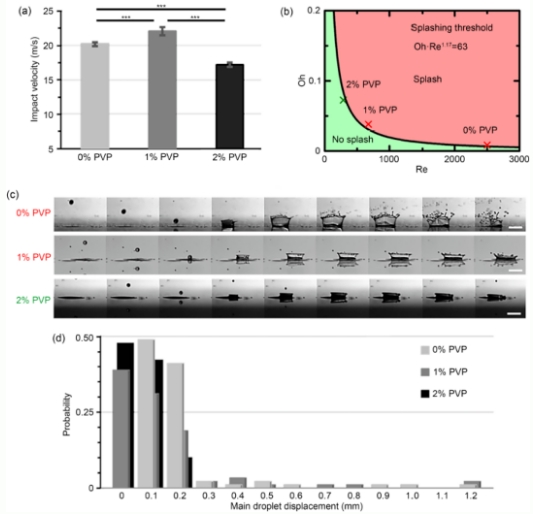
图3(a)通过高速图像测量的在液滴撞击到基底前的液滴冲击速度(0%,1%,和2%的PVP基的生物墨水)。数据以平均值±标准差的方式呈现,n=15,***p<0.001;(b)基于溅射边界条件计算得出的液滴溅射相图;(c)以5倍变焦和每秒144,000帧速率拍摄的具有代表性的从液滴形成到液滴碰撞基底的高速图像;(d)基于90个主液滴分析得到的主液滴的位移。PVP:聚乙烯吡络烷酮
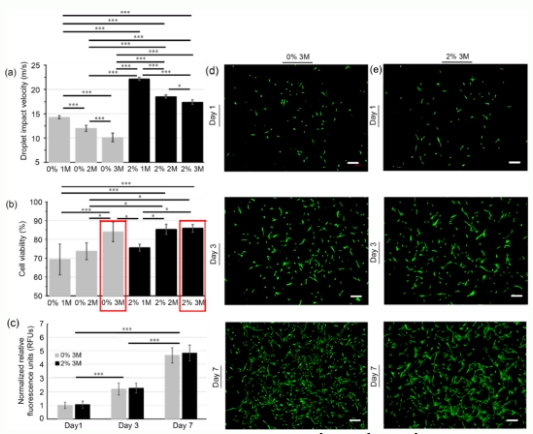
图4(a)基于0%和2%PVP的生物墨水中,细胞密度(1×106,2×106和3×106)对产生的液滴的冲击速度的影响;(b)0%和2%PVP生物墨水中,细胞密度(1×106,2×106和3×106)对对打印后瞬时细胞存活率的影响;(c)基于PrestoBlue检测法得到的归一化RFUs分析0%和2%PVP基生物墨水在不同打印时间的细胞增殖曲线。数据以平均值±标准差的方式呈现,n=15,*p<0.05,***p<0.001。(d),(e)基于0%和2%PVP基的生物墨水形成体积为30nL的载细胞液滴打印后的7天内,基于活死细胞染色试剂染色的含有原代人源表皮成纤维细胞的代表性荧光图像,比例尺=200µm。PVP:聚乙烯吡络烷酮;1M:1´106个细胞/毫升;2M:2×106个细胞/毫升;3M:3×106个细胞/毫升
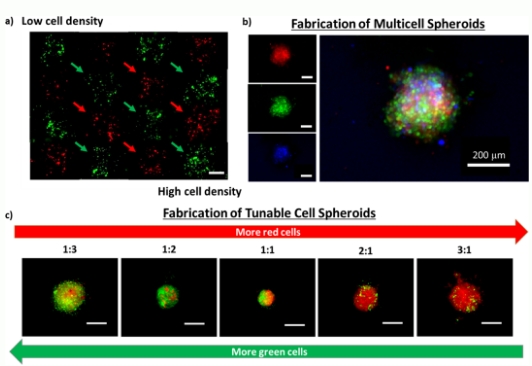
图5(a)在预定位置进行载细胞液滴的沉积(其中,左上角代表低细胞密度,右下角代表高细胞密度);(b)基于橙色、绿色以及蓝色细胞质膜染料染色的原代人源成纤维细胞制备的多细胞球体;(c)基于橙色和绿色的细胞质膜染料染色的原代人源成纤维细胞制备的具有不同体积比的细胞球。比例尺=200µm



